![]()
A gázok állapotváltozását az állapotjelzők megváltozásából
észlelhetjük. Az állapotjelzők közötti összefüggéseket a gáztörvények
írják le. |
Izotermikus
állapotváltozásról beszélünk ha a gáz állapot- változása állandó
hőmérsékleten megy végbe (T = állandó). Ilyenkor a gáz
nyomásának és térfogatának szorzata állandó. Matematikai megfogalmazásban pˇ
V = állandó. |
Állandó nyomáson megy végbe az izobár állapotváltozás, |
Izochor
állapotváltozás esetén a gázok állapotváltozása állandó
térfogat mellett megy végbe, V = állandó. |
| Adiabatikus
állapotváltozásról beszélünk ha a tökéletes gáz
állapotváltozása a környezettől termikusan elszigetelt térben megy végbe ( DQ=0). Mivel a rendszer és a környezete között nincs hőcsere, a sűrítési munka a gáz belső energiáját növeli, ezért a gáz felmelegszik, expanzió során pedig csökken a gáz belső energiája, ezért lehül. Az adiabatikus állapotváltozás törvénye: p ˇVk = állandó. Két állapot között tehát p1ˇ V1k = p2 ˇV2k , ahol a k (kappa) az adiabatikus állapotváltozási kitevő (fajhő viszony), az állandó nyomáson vett fajhő (cp) és az állandó térfogaton vett fajhő (cv) hányadosa, k = cp/cv. A V kitevője k > 1, a p-V diagram az izotermánál meredekebb hiperbola |
| Politropikus
állapotváltozás A valóságos gépekben sem az izoterm sem az
adiabatikus állapotváltozás nem valósítható meg tökéletesen, mert a hűtés
tökéletlensége miatt a hőmérséklet nem marad állandó, a hőszigetelés hatásfoka
is korlátozott. A gyakorlatban
lejátszódó változások ezért a két folyamat közé esnek, az ilyen
állapotváltozásokat nevezzük politropikusnak. Ennek egyenlete: p ˇVn = állandó, vagyis p1 ˇV1n = p2 ˇV2n, ahol az n politropikus kitevő, értéke k és l közé esik ,a V kitevője n= (1<n<k), a p-V diagram az izoterma és az adiabata között futó hiperbola. |
|
Izoterm
állapotváltozásnál p ˇV = állandó, |
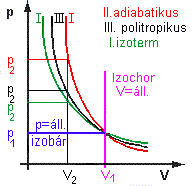
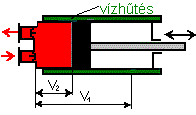
| Az ábrán vázolt dugattyús sűrítő V1 térfogatában p1
kezdő nyomásról indulva az állandó m tömegű gáz térfogatát V2-re
csökkentjük. Különböző állapotváltozások esetén a p2
nyomást a diagramról olvashatjuk le. Azt tapasztaljuk, hogy a V2
térfogaton az izoterm
állapotváltozás esetén
legkisebb a nyomás, és adiabatikus esetben a legnagyobb, vagyis adiabatikus kompresszióval nagyobb nyomás
érhető el, de közben a gáz felmelegszik. Politropikus változáskor a kettő közötti nyomás alakul. ki. 1.-2. mintafeladat 3. összetett feladat
|